Kontroverzní, riziková, a také experimentální – za takovou donedávna platila terapie fekální transplantace. V poslední době vstupuje do oficiální lékařské praxe a po světě rostou banky na uchování fekálního materiálu.
Stále ji ovšem provází otazníky, ať už se týkají dárců, kterým se přezdívá „jednorožci“, nebo ojedinělé případy, které skončily úmrtím pacienta.

Jedna z prvních věcí, kterou udělá průměrná koala hned po narození, je, že začne hodovat na výkalech své matky. Bez toho nemá šanci přežít. Stejně jako sloni nebo hroši se i koaly rodí se sterilními střevy, s kterými je trávení potravy nemožným úkolem.
K ozdravení střevní mikroflóry má průměrný člověk k dispozici probiotika nebo prebiotika. Někdy ale jeho stav přímo volá po podobném řešení, ke kterému se uchyluje novorozená koala.
Fekální bakterioterapie platila ještě v nedávné době za terapii poslední záchrany. Svou úspěšností v léčení opakujících se infekcí, které nereagují na antibiotika, ale její prominence stoupá.
Nedávné případy úmrtí pacientů následkem provedené fekální transplantaci ovšem vedly ke zpochybnění bezpečnosti celé terapie.

Evolučně podmíněná symbióza
Prokaryotické mikroorganismy, kam kromě řádu bakterií patří také Archaea, obydlely každý kout planety Země. Čtyři miliardy let evoluce způsobily, že dokážou přežít i v mimořádně nehostinném prostředí.
Není proto divu, že když se před přibližně 200 000 lety objevil první člověk, osídlili i toto „území“. Lidské tělo jim totiž poskytlo jednu příhodnou podmínku – stálou teplotu, která prospívá mikrobiálnímu růstu.
Dnes se na povrchu i uvnitř lidského těla nacházejí symbiotické komunity tisíců nejrůznějších druhů bakterií, virů, hub a dalších mikroorganismů. Dohromady váží asi 2 kg a tvoří rozmanitý mikrobiom člověka.
Odhaduje se, že 25letý muž s váhou 70 kg a výškou 170 cm má v těle asi 4 × 1013 mikrobiálních buněk. To je 1,3krát více než množství lidských buněk, kterých je asi 3 × 1013, z toho ale celých 84 % tvoří buňky červených krvinek.
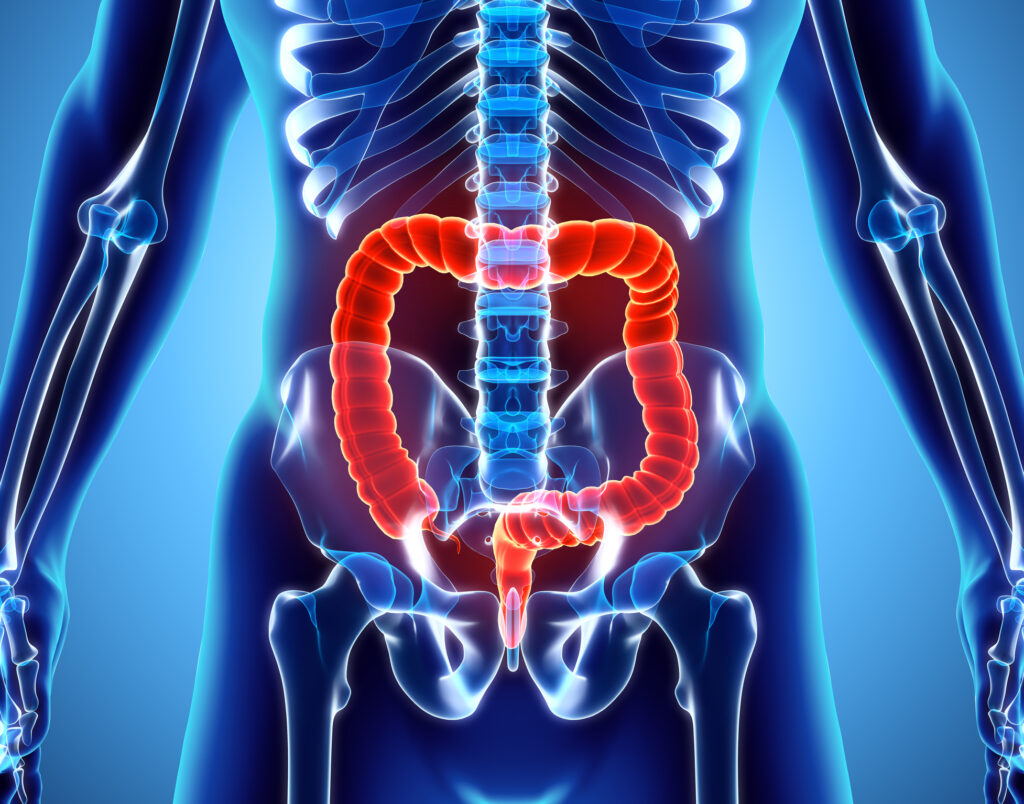
Pokud bychom počítali pouze buňky s jádrem, mezi které červené krvinky nepatří, tento podíl by rázem stoupl na 10 mikrobiálních buněk na každou jednu lidskou buňku. A 99 % těchto cizorodých buněk se nachází právě v tlustém střevě.

Síla je v rozmanitosti
Někdy na přelomu 20. a 21. století přišli odborníci se zjištěním, že mikrobiom přímo ovlivňuje zdraví svého hostitele, jeho metabolismus, imunitu a dokonce i náladu.
Na kondici tohoto „pralesa“, který někteří odborníci považují za další lidský orgán, se podepisuje způsob, jakým se jeho majitel stravuje, jak žije, i v jakém prostředí se pohybuje. Zdravý mikrobiom znamená rozmanitý mikrobiom.
Právě tento klíčový předpoklad se stává kamenem úrazu v moderní společnosti, která se živí jednotvárnou stravou a užívá antibiotika. Dodávku nových mikrobů lze ale ve vrchovaté míře doplnit právě transplantací mikrobiomu.
Jde o přenos fekálního materiálu zdravého jedince do střev nemocného člověka. Tuto starodávnou metodu léčby moderní medicína znovuobjevila teprve nedávno, a i poté stála na samém okraji zájmu.
Do popředí pozornosti lékařů se dostala až díky souvislosti s nepříjemnou střevní infekcí, kterou vyvolává bakterie C. difficile.

Superodolná bakterie
Bakterie C. difficile se běžně nachází ve střevech zdravých lidí, kde většinou nezpůsobuje žádný problém. V organismu jedince s oslabenou imunitou ale dokáže vyvolat střevní zánět, projevující se horečku, křečemi a průjmem.
Asi v 70 % případů lze úspěšně léčit antibiotiky, konkrétně vankomycinem. Problém ale nastává ve zbylých případech, kdy se navzdory léčbě C. difficile neustále vrací.
Opakované užívání antibiotik ústí v totální rozklad mikrobiomu, bakterie přebírá ve střevě nadvládu a nastává stav známý jako klostridiová kolitida (CDI). Tato infekce je vysoce odolná proti další antibiotické léčbě a může ústit až v pacientovo úmrtí. Jen v USA způsobí téměř půl milionu infekcí každý rok a zabije 15 000 osob.
Díky slibným výsledků studií na laboratorních hlodavcích přišel začátkem 21. století návrh léčit CDI pomocí bakterií ze zdravého lidského střeva.
V roce 2013 byla publikována data z první kontrolované klinické studie na pacientech trpících opakujícími se CDI. Právě vankomycin v kombinaci s FMT se ukázal jako nejefektivnější řešení, následkem kterého se bakteriální diverzita mikrobiomu téměř zcela obnovila.
V současnosti je fekální mikrobiální transplantace u pacientů s opakující se CDI úspěšná z 85–90 %. Oproti léčbě antibiotiky má navíc nepopiratelné výhody – je ekonomičtější a redukuje rozvoj antibiotické odolnosti bakterií.
Nástup zlatého věku
Posledních 10 let stojí transplantace stolice v centru pozornosti.
Byla zahájena řada studií zkoumající lidský mikrobiom, vznikají jednotné směrnice pro léčbu opakujících se CDI, jsou zakládány národní mikrobiomové společnosti – tuzemská vznikla při České lékařské společnosti Jana Evangelisty Purkyně na jaře 2020. Za 10 let, kdy se u nás transplantace fekální mikrobioty coby alternativní léčba využívá, bylo provedeno na šest stovek výkonů s účinností kolem 85 %.
Nejčastěji se využívá stolice od rodinných příslušníků pacienta, není to ale podmínkou. V roce 2012 vznikla první veřejná banka stolice zdravých dárců, když tým výzkumníků z Massachusettského technologického institutu založil projekt OpenBiome.
Podobná zařízení začala růst také po Evropě a v letošním roce by biobanka měla vzniknout také v Praze na Vinohradech z iniciativy lékařů Fakultní nemocnice Královské Vinohrady.
Jak uvedl MUDR: František Duška, „chceme směřovat k tomu, že budeme mít banku stolice zdravých dárců pro mikrobiální transplantace nejen klinicky použitelné, ale i pro experimentální použití a další vývoj.“